Für Fachpersonal.

Hintergrund
Bei fehlender Evidenz, dass die frühere Detektion einer (asymptomatischen) Fernmetastasierung einen (Überlebens-) Vorteil für PatientInnen mit frühem Mammakarzinom bringt, beschränkt sich die Bildgebung in der Nachsorge des primären Mammakarzinoms auf die jährliche Mammo- und gegebenenfalls ergänzende Sonographie. Weitere Bildgebung sollte nur bei Beschwerden der PatientIn veranlasst werden. Dieses Vorgehen beruht auf großen prospektiven Studien aus den 1980er Jahren [1, 2] – aktuellere Studien zur Prüfung dieses Vorgehens in der Nachsorge fehlen. Während aber die Brustkrebsinzidenz über die letzten Jahrzehnte stets anstieg (2020 in Deutschland 82,2/100.000), hat sich die 5-Jahres-Überlebensrate seit den 1980er Jahren (69 %) um über 20% verbessert auf über 90% [3]. Neben der Diagnosestellung in früheren Stadien durch das etablierte Mammographie-Screening-Programm wirken sich insbesondere die Weiterentwicklungen der therapeutischen Optionen positiv auf den Krankheitsverlauf aus. PatientInnen steht heute sowohl in der Primärtherapie, als auch im Falle einer Metastasierung ein großes Spektrum an (zielgerichteten) Substanzen zur Verfügung, deren Wirkung gut untersucht und publiziert ist.
Die SURVIVE hat es sich zum Ziel gesetzt, die heute gängige Nachsorgepraxis zu hinterfragen und zu untersuchen, ob sich durch eine intensivierte Nachsorge nicht nur eine Lead Time generieren lässt, wie bereits von Del Turco 1994 beschrieben [2], sondern sich dies auch auf das Gesamtüberleben übersetzt.
1. Liberati, A. The GIVIO trial on the impact of follow-up care on survival and quality of life in breast cancer patients. Annals of Oncology 6, S41–S46 (1995).
2. Del Turco, M. R. Intensive Diagnostic Follow-up After Treatment of Primary Breast Cancer: A Randomized Trial. JAMA 271, 1593 (1994).
3. de Gregorio, A. et al. Gemcitabine as adjuvant chemotherapy in patients with high-risk early breast cancer-results from the randomized phase III SUCCESS-A trial. Breast Cancer Res 22, 111 (2020).
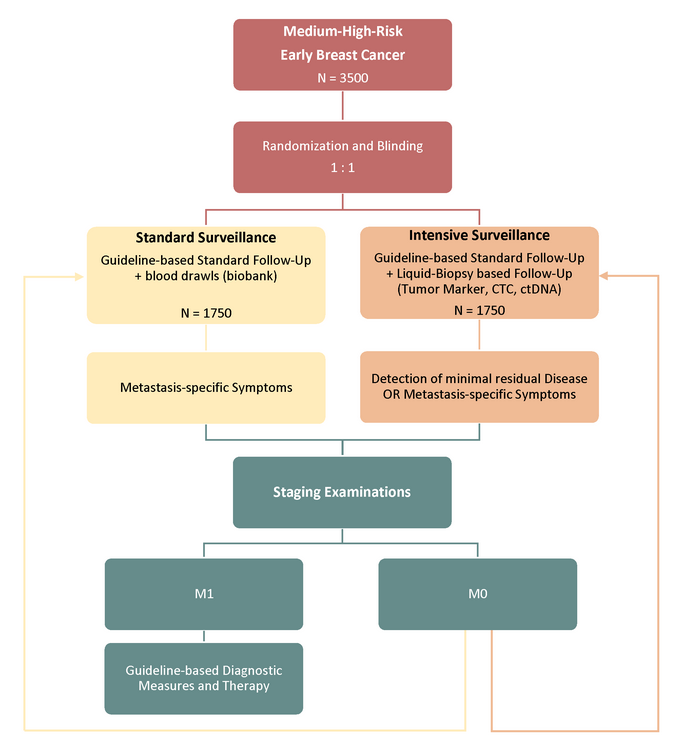
Studiendesign
In der vom BMBF (Bundesministerium für Bildung und Forschung) geförderten, 1:1 randomisierten, teil-verblindeten, multizentrischen kontrollierten Überlegenheitsstudie SURVIVE, soll bei 3.500 Brustkrebs-PatientInnen mit mittlerem bis hohem Risikoprofil die aktuelle Standardnachsorge mit einer auf liquid biopsy basierenden (intensivierten) Nachsorge verglichen werden. Nach 2 Baseline-Visiten und Butentnahmen werden in beiden Armen zu den etablierten Nachsorgezeitpunkten (Jahr 1-3 alle 3 Monate, Jahre 4 und 5 alle 6 Monate) Blutproben im Studienzentrum entnommen und im Interventionsarm auf Tumormarker (CA27.29, CEA, CA125), zirkulierende Tumorzellen (CTC) und zirkulierende Tumor-DNA (ctDNA) untersucht. Auffälligkeiten dieser Marker werden als Hinweis auf minimale Resterkrankung (MRD) gewertet und es erfolgt ein Staging zur Metastasensuche (CT Thorax/Abdomen, Knochenszintigramm). Falls eine Metastasierung detektiert wird, erfolgt die leitliniengerechte Behandlung. Andernfalls wird die intensivierte Nachsorge mit liquid biopsy Testungen fortgeführt.
Die Proben des Standardarms werden nicht direkt analysiert, sondern in einer Biobank für retrospektive (und translationale) Forschungsprojekte gelagert.
Die Lebensqualität, insbesondere die Angst vor einem Progress oder Rezidiv, wird mit zwei standardisierten Fragebögen (EORTC-QLQ-C30 und PA-F12) erfasst.
Ablauf der Studie
Gesamtstudienlaufzeit: 12 Jahre (First Patient In – End of Study): 12.2022 – 11.2034
Nachbeobachtung: 5 Jahre
Rekrutierungszeitraum: 2 Jahre: 12.2022 – 11.2024
Gesamtstudienlaufzeit je Patientin: 10 Jahre
Intervention (Blutentnahmen): 5 Jahre
- Insgesamt 18 Blutentnahmen: 2 Basisvisiten und 16 Studienvisiten
- Visiten in den Jahren 1-3 alle 3 Monate, in den Jahren 4 und 5 alle 6 Monate
- Erheben der Lebensqualität zur Basisvisite, dann alle 6 Monate
Nachbeobachtung: 5 Jahre
- Jährliche Kontaktaufnahme (via App, per Telefon, E-Mail oder als Visite im Studienzentrum) zur Beantwortung eines Fragebogens sowie der Lebensqualität
N.B. Alle studienbezogenen Untersuchungen finden zusätzlich zur regulären Nachsorge beim nachsorgenden (Frauen-) Arzt statt.
Ein- und Ausschlusskriterien
Einschlusskriterien:
Ein Einschluss von PatientInnen ist nur möglich, wenn alle nachfolgenden Kriterien erfüllt werden:
- Unterschriebene Einverständniserklärung für alle Studienmaßnahmen analog der bestehenden lokalen regulatorischen Anforderungen bevor Studien-spezifische Maßnahmen stattfinden.
- Primärer, unilateraler oder bilateraler, histologisch gesicherter Brustkrebs.
- PatientInnen mit einem mittleren bis hohen Rezidivrisiko, definiert als eines der folgenden Kriterien
- Indikation für eine (neo-)adjuvante Chemotherapie (unabhängig davon, ob diese durchgeführt wurde) oder
- Großer Tumor (> 50mm), oder
- Positive Lymphknoten, oder
- Hohes Grading (G3).
- Komplettresektion des Primärtumors mit freien Schnitträndern (R0).
- Beendigung der primären Tumortherapie (adjuvante Chemotherapie, Operation oder Strahlentherapie, je nachdem was als Letztes stattfand) maximal 24 Monaten vor Einschluss. Ein Einschluss von PatientInnen unter adjuvanter Therapie, welche keine Chemotherapie ist (zum Beispiel antihormonelle Therapie, Antikörper-Therapie, Therapie mit CDK4/6-Inhibitoren, PARP-Inhibitoren oder PI3K Inhibitoren, sowie Antikörper-Drug-Konjugate oder andere neue Substanzen) ist erlaubt.
- Verfügbarkeit von Primärtumor-Gewebe (entweder als FFPE Glasträger (≥ 6 mm³, mind. 10 Träger, Dicke: 5µm-10 µm, Oberfläche >150 mm² und 1 H&E gefärbter Träger, mind. 20% Tumorgehalt) oder FFPE Block (≥ 6 mm³ Dicke: 100 µm, Oberfläche: >150 mm² und 1 H&E gefärbter Träger, mind. 20% Tumorgehalt) oder genomische DNA extrahiert von FFPE Trägern oder Block (≥ 600ng, Mindestvolumen: 25 µL, Konzentration: 20 ng/µL, Buffer: 10 mM Tris pH 8, 1 mM EDTA)) zum Zeitpunkt des Studieneinschlusses
- PatientInnen mit primär systemischer Therapie: cave: ggfs. Tumorgewebe aus der initialen Biopsie bei Erstdiagnose
- PatientInnen mit primär operativer Therapie: chirurgisch entferntes Tumorgewebe.
- Kein klinischer Hinweis auf eine Fernmetastasierung (cM0).
- Frauen oder Männer ≥ 18 Jahre und ≤ 75 Jahre.
- Guter Allgemeinzustand, gemessen als Status ≤ 1 auf der Eastern Cooperative Oncology Group (ECOG) Skala.
- Bereitschaft der PatientInnen zur Einhaltung der geplanten Studienvisiten, Blutabnahmen, Diagnostik sowie weiterer Maßnahmen im Rahmen der Studie.
Ausschlusskriterien:
Ein Einschluss von PatientInnen ist nur möglich, wenn keines der folgenden Kriterien zutrifft:
- PatientInnen mit einer weiteren Krebserkrankung in der Vorgeschichte, mit Ausnahme der folgenden Erkrankungen:
- in situ Karzinom des Gebärmutterhalses
- adäquat behandeltes Basalzellkarzinom der Haut
- ipsi- oder kontralaterales non-invasives Karzinom der Brust (DCIS).
- Patientinnen in der Schwangerschaft oder Stillzeit.
- Vorgeschichte einer signifikanten neurologischen oder psychiatrischen Erkrankung, einschließlich psychiatrischer Störungen, Demenz oder Krampfanfälle, die an dem Verständnis oder dem Einverständnis der Patientin zweifeln lassen.
- Niereninsuffizienz mit GFR < 30 mL/min.
- Vorausgehende oder begleitende zytostatische oder andere systemische Behandlung, welche nicht der Behandlung des primären Brustkrebses dient.
Endpunkte
Zwei primäre Endpunkte werden untersucht:
- Gesamtüberleben (Overall Survival): Vergleich des Gesamtüberlebens nach fünf Jahren zwischen dem Standard Nachsorge Arm und dem Intensivierten Nachsorge Arm.
- Gesamt-Vorlaufzeit (Overall Lead Time): Bestimmung der Gesamt-Vorlaufzeit (Overall Lead-Time), welche durch Biomarker (Tumormarker / CTC /ctDNA) -basierte Intensivierte Nachsorge im Vergleich zur Standardnachsorge nach Beendigung der Primärtherapie bei BrustkrebspatientInnen generiert wird.
Auszug der sekundären Endpunkte
- Invasive disease-free survival (IDFS)
- Distant disease-free survival (DDFS)
- Distant recurrence-free survival (DRFS)
- Breast cancer specific survival (BCSS)
- Invasive breast cancer free survival (IBCFS)
- Overall Survival (OS) after 10 Years
- Molecular to via Imaging verified Distant Recurrence Lead Time in the Interventional arm
- Quality of life (QoL) with questionnaires: EORTC QLQ-C30 and PA-F12
- Liquid biopsy sensitivity (CA27.29, CEA, CA125, CTC and ctDNA)
- Liquid biopsy specificity (CA27.29, CEA, CA125, CTC and ctDNA)
- Liquid Biopsy False-Positive Rate (CA27.29, CEA, CA125, CTC and ctDNA)
- Liquid Biopsy False-Negative Rate (CA27.29, CEA, CA125, CTC and ctDNA)
- Rate of liquid biopsy positivity (CA27.29, CEA, CA125, CTC and ctDNA)
Studienzentren
Eine Übersicht der teilnehmenden Zentren